Blindenschrift auf Pharma-Verpackungen gilt seit langer Zeit als Standard. In der Zwischenzeit werden die Braille-Punkte auch auf Verpackungen im Lebensmittel- und Drogeriebereich appliziert. Hier gilt es einige Normen und Richtlinien zu berücksichtigen.
Gesetzliche Grundlagen und Richtlinien
In vielen Ländern gibt es Gesetze, die den Umgang mit behinderten Menschen regeln, um möglichst eine Gleichstellung zu erreichen. In Deutschland ist dies das Behindertengleichstellungsgesetz (BGG) [1]. Blindheit ist darin nicht ausdrücklich erwähnt, sondern unter dem Begriff „Sinnesbeeinträchtigungen“ subsumiert. Ein zentraler Punkt ist die Sicherstellung des Zugangs zu wichtigen Informationen auch für Menschen mit Behinderung. Auf dieser Grundlage wurde in zahlreichen Ländern festgelegt, dass auf den Verpackungen (meist Faltschachteln aus Karton) von Medikamenten der Name sowie ggf. Darreichungsform und Wirkstoffmenge in gut lesbarer Blindenschrift (Braille) aufgebracht werden müssen. Details sind in diversen Richtlinien niedergelegt. Für Deutschland gilt die DIN 32986 [2], für Europa die EU-Richtlinie 2004/27/EG [3] sowie die mit DIN 32986 inhaltsgleiche Norm EN 15823. International ist seit 2013 die ISO 17351 "Packaging - Braille on packaging for medicinal products" [4] die entscheidende Richtlinie für Hersteller und Nutzer von Braille-Prüfsystemen. Der relevante Textausschnitt lautet:
“For embossed materials the target Braille cell dot height shall be 0.20 mm with not more than 5 % of Braille cell dot height measurements lower than 0.12 mm and not more than 1 % of Braille cell dot height measurements lower than 0.10 mm. The Braille cell dot height can be measured using a calibrated, spring-loaded (spring-force not less than 0.5 N) micrometer with an anvil that covers at least three Braille dots in a cell. Measurement of the Braille cell dot height shall use cells containing at least three dots. Alternative methods may be used provided that they are of at least equivalent precision and accuracy. Measurements can be performed with two decimal places and results shall be reported to two decimal places.”
Für die Interessen der Blinden sowie für die Bereitstellung von Hilfsmitteln und Literatur setzen sich im In- und Ausland zahlreiche Organisationen ein [5][6][7].
Für das Braille-Alphabet gibt es eine Reihe unterschiedlicher Definitionen und Normen, die aber alle von einem Muster aus sechs Punkt-Positionen pro Zeichen-Zelle ausgehen. Am weitesten verbreitet und auch in vielen Ländern in der Pharmaindustrie als Standard etabliert ist die Variante Marburg Medium [8]. Abbildung 1 zeigt die entsprechenden Kenngrößen. Die Höhen der Braille-Punkte sind dabei allerdings nicht in den Beschreibungen der Alphabete festgelegt, sondern nur in den o. g. Normen. Sie sollten ca. 0,2 mm hoch sein, aber nicht so hoch, dass durch das Prägen der Farbauftrag auf dem Karton aufplatzt.
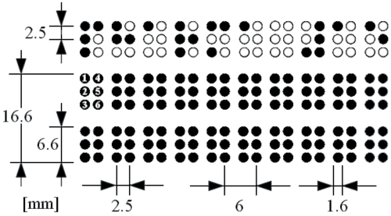
Abbildung 1: Anordnung der Braille-Punkte nach Marburg-Medium
Mit den sechs Braille-Punkten pro Zelle lassen sich 64 verschiedene Zeichen darstellen. Wegen dieser Einschränkung verzichtet man auf Großbuchstaben. Ziffern kennzeichnet man mit dem Ziffernzeichen (siehe Abb. 1), gefolgt von den Buchstaben a bis i für die Ziffern 1 bis 9 und j für 0. Der Abschluss einer Ziffernfolge wird durch ein Leerzeichen markiert. Die Blindenschrift ist nicht redundant, d. h. eine zusätzlicher oder fehlender Braille-Punkt führt nicht zu einem Fehlerzeichen, sondern immer zu einem anderen, gültigen Zeichen. Auch deswegen ist eine sorgfältige Prüfung des Prägebildes wichtig. Auf Details der Codierung und deren nationale Unterschiede wird hier nicht weiter eingegangen. Einzelheiten dazu findet man beispielsweise in [8].
Anforderungen an die normgerechte optische Inspektion von Braille
Die Braille-Zeichen werden üblicherweise in den Druckereien nach dem Bedrucken der noch flachen, in großen Bögen angeordneten Faltschachteln in einer Prägemaschine oder in der Klebemaschine durch eine Rotationsprägewalze aufgebracht. In der Qualitätskontrolle werden in der Regel alle aus dem ersten Druckbogen ausgestanzten Faltschachteln einzeln geprüft. Oft werden noch weitere Bögen während der laufenden Produktion sowie der letzte gedruckte Bogen untersucht. Die Pharmafirmen verlassen sich zumeist auf die Protokolle der Druckereien, üblich sind aber auch in der Pharmaindustrie zumindest Prüfungen von Stichproben im Wareneingang.
Eine Studie über die für eine Lesbarkeit erforderliche minimale Noppenhöhe, die zulässigen Toleranzen und geeignete Messmethoden findet man in [9]. Legt man dies alles zugrunde so kommt man zu den folgenden Anforderung an eine normgerechte optische Braille-Inspektion:
Vergleich des Prägebilds mit einem Referenzmuster, beispielsweise einer PDF-Datei
Höhenprüfung: Vermessung von Position und Höhe jedes Braille-Punkts
Statistische Bewertung: maximal 5% der Braille-Punkte dürfen niedriger als 0,12 mm sein, maximal 1 % niedriger als 0,1 mm
Höhenauflösung: besser als 10 % der Sollhöhe von 0,2 mm
Höhenwerte sollen in Millimetern mit zwei Nachkommastellen angegeben werden
Analyse der Braille-Punkte auf der bedruckten Vorderseite, da von dieser auch die Blinden lesen
Analysegeschwindigkeit: mindestens eine Faltschachtel pro Sekunde für Off-Line-Anwendungen
Dreidimensionale Erfassung von Flächen mit Erhebungen, die klein gegen die laterale Ausdehnung sind
Berücksichtigung der Störeinflüsse von Farb- und Helligkeitskontrasten
Als wichtigster Punkt kommt hinzu, dass alternative Methoden zulässig sind, wenn sie mindestens die Genauigkeit (accuracy) und die Wiederholgenauigkeit (precision) der mechanischen Messung erreichen. Dies kann durch Vergleichsmessungen nachgewiesen werden.
| [1] | BGG: Behindertengleichstellungsgesetz. http://www.gesetze-im-internet.de/bgg/BGG.pdf |
| [2] | DIN 32986:2019-06: Taktile Schriften und Beschriftungen - Anforderungen an die Darstellung und Anbringung von Braille- und erhabener Profilschrift. Beuth-Verlag (2019) |
| [3] | EU-Richtlinie 2004/27/EG: Schaffung eines Gemeinschaftskodexes für Humanarzneimittel. https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32004L0027&from=LV |
| [4] | ISO: Packaging - Braille on packaging for medicinal products (DIN EN ISO 17351) https://www.iso.org/standard/59616.html |
| [5] | AFB: American Foundation of the Blind. https://www.afb.org/news-publications/publications |
| [6] | RNIB: Royal National Institute of Blind People. https://www.rnib.org.uk/ |
| [7] | DZB: Deutsches Zentrum für barrierefreies Lesen. https://www.dzblesen.de/ DBSV: Deutscher Blinden- und Sehbehindertenverband e.V. https://www.dbsv.org/ |
| [8] | Birgit Adam: Das Buch der Blindenschrift. Marix-Verlag (2009) |
| [9] | G. Douglas, A.Weston, J. Whittaker, S. Morely Wilkins and D. Robinson: Braille dot height research: Investigation of Braille dot elevation on pharmaceutical products. Final Report Univ. of Birmingham and RNIB, ISBN 0704426919/9780704426917 (2007) https://www.birmingham.ac.uk/Documents/college-social-sciences/education/victar/braille-dot-height.pdf |


